Việc chính phủ có nên chấp nhận việc sử dụng khẩn cấp vaccine Nanocovax hay không đang là đề tài gây tranh cãi. Bài viết này chỉ tập trung phân tích khía cạnh khoa học, và tình hình các nước xử trí vấn đề thế nào để đem lại một góc nhìn khách quan cho vấn đề cấp phép vaccine ở Việt Nam.
MỌI VACCINE ĐỀU PHẢI VƯỢT QUA THỬ NGHIỆM LÂM SÀNG RỒI MỚI ĐƯỢC CHÍNH THỨC CHẤP NHẬN
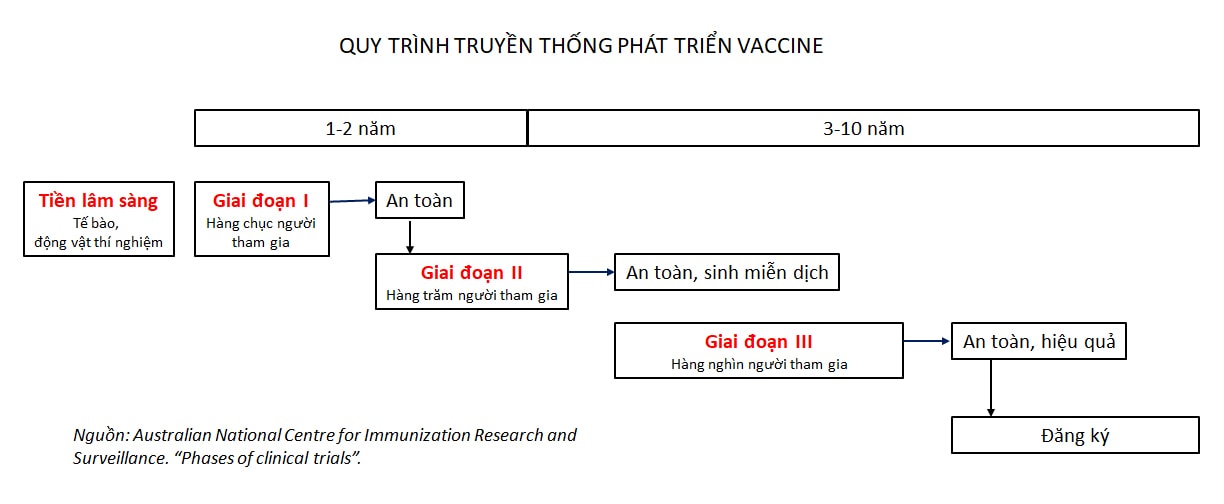
Theo chuẩn quốc tế truyền thống, vaccine phải qua được 3 vòng (giai đoạn, pha) thử nghiệm lâm sàng mới được chính thức chấp nhận bởi các cơ quan quản lý dược phẩm.
Giai đoạn I để xác định liều lượng vaccine và độ an toàn cho người được sử dụng. Giai đoạn này cần ít nhất 1 năm và thường cần vài chục người tình nguyện tham gia.
Giai đoạn II để đánh giá mức độ sinh miễn dịch, và tiếp tục đánh giá độ an toàn. Mức độ sinh miễn dịch được đánh giá qua mẫu máu người tình nguyện, trong đó mức kháng thể và hoạt tính các tế bào trung hòa được kháng nguyên mầm bệnh là 2 thành phần quyết định. Giai đoạn này cần vài trăm tình nguyện viên. Đa số các ứng viên vaccine thường bị loại trong giai đoạn II này.
Giai đoạn III để đánh giá hiệu quả và an toàn trong thực tế, khi người tình nguyện có tiếp xúc với mầm bệnh. Giai đoạn này cần hàng nghìn người tham gia và kéo dài vài năm.
Các giai đoạn thử nghiệm lâm sàng thường được đăng ký công khai trên một số trang web.
CÓ THỂ CHẠY TẮT HAY KHÔNG?
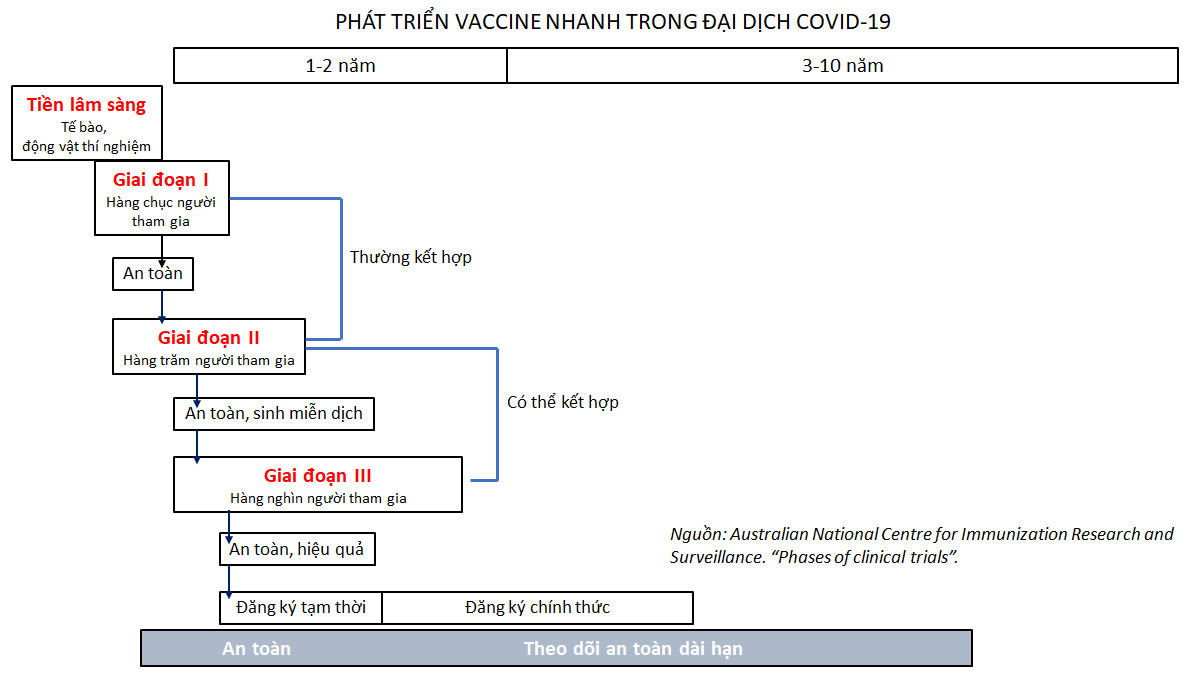
Trong thực tế đại dịch Covid-19, hầu như tất cả các vaccine đều đã được phát triển theo quy trình "chạy tắt". Tuy nhiên việc "chạy tắt" này phải dựa trên các cơ sở khoa học.
Thứ nhất, dịch Covid-19 có họ hàng rất gần với dịch SARS cũng xuất hiện ở Nam Trung Quốc năm 2002, và MERS ở Trung Đông năm 2012, nên các bài học trước đó đã được áp dụng rất nhanh chóng. Ngay sau khi giải mã được hệ gene Covid-19 người ta lập tức nghiên cứu vaccine và chỉ 2 tháng đã bắt đầu thử nghiệm giai đoạn I cho những vaccine đầu tiên.
Thứ hai, các giai đoạn thử nghiệm lâm sàng có thể gối đầu lên nhau, miễn là cung cấp đầy đủ số liệu cho cả 3 giai đoạn.
Trên thực tế người ta đã vừa xác định liều lượng và độ an toàn (là việc của giai đoạn I), vừa đo hoạt tính sinh miễn dịch (là việc của giai đoạn II). Với một vài vaccine, giai đoạn II và giai đoạn III được kết hợp, nghĩa là việc đo lường hoạt tính sinh miễn dịch được thực hiện ngay trong thực chiến cùng với việc xác định hiệu quả bảo vệ trong điều kiện đại dịch đang hoành hành.
Cách làm mới này đã mang lại thành công ngoạn mục trong vòng hơn một năm, góp phần làm dừng và giảm tốc độ lây lan tại những quốc gia trước đây chịu thiệt hại nhiều nhất.
Việc nhiều vaccine đã được WHO và các quốc gia cấp phép sử dụng khẩn cấp không có nghĩa là các vaccine này đã có giấy phép đầy đủ. Và ngay cả sau khi hoàn tất thử nghiệm lâm sàng giai đoạn III rồi, thì vẫn cần 3-10 năm nữa để phát hiện tiếp các hiệu ứng lâu dài, hoặc hiệu ứng rất hiếm, chỉ thấy được khi có hàng chục, hàng trăm triệu người được chích vaccine (1).
MINH BẠCH LÀ YÊU CẦU CỐT LÕI
Các vaccine AstraZeneca, Pfizer, Moderna… đã thành công trong việc thuyết phục các chính phủ và người dân không chỉ nhờ công nghệ tiên tiến, mà còn nhờ minh bạch thông tin.
Các thử nghiệm lâm sàng không những được đăng ký trên các trang web công khai, mà kết quả của chúng còn phải được công bố trên các tạp chí khoa học có bình duyệt, với các tác giả là các nhà khoa học không có xung đột lợi ích, hoặc nếu ai có thì phải công khai cho người đọc.
Cho đến thời điểm hiện tại, trang PubMed của Viện Sức khỏe Mỹ đăng ký được 583 bài báo về vaccine của Pfizer, đa số đăng trên các tạp chí được bình duyệt. Tương tự, con số cho AstraZeneca là 303. Việc được các tạp chí y khoa hàng đầu như Lancet chấp nhận công bố các kết quả nghiên cứu được coi là chứng chỉ khoa học cho các vaccine này.
Vaccine Sputnik V của Viện Gamalea (Moskva) khi mới xuất hiện đã gây nghi ngờ trong dư luận quốc tế, lý do vì Tổng thống Putin ra tuyên bố chấp nhận trước cả khi các nhà khoa học Nga chính thức công bố kết quả thử nghiệm lâm sàng giai đoạn I và II.
Tuy nhiên sau đó vaccine Nga đã được cộng đồng quốc tế chào đón ấm áp hơn, với việc lần lượt công bố các kết quả thử nghiệm giai đoạn I, II và III trên tạp chí Lancet. Hiện tại, có 25 bài báo về vaccine Sputnik được PubMed ghi nhận (2).
Vaccine do hãng tư nhân Sinovac của Trung Quốc phát triển đã công bố kết quả thử nghiệm lâm sàng giai đoạn I và II dưới dạng công trình có bình duyệt trên tạp chí Lancet uy tín hồi tháng 11/2020 và tháng 2/2021. Thử nghiệm giai đoạn III có đăng ký từ năm 2020 đang được giới khoa học chờ đợi công bố dưới dạng bài báo khoa học có bình duyệt.
Số liệu về vaccine Sinopharm (Trung Quốc) cho hiện chưa có công bố khoa học có bình duyệt (3).
NANOCOVAX CỦA VIỆT NAM: LIỆU CÓ THỂ VỪA CHẠY VỪA XẾP HÀNG?
Nanocovax là vaccine protein tái tổ hợp do công ty tư nhân Nanogen (trụ sở tại Quận 6 TPHCM) phát triển. Việc thử nghiệm lâm sàng do Học Viện Quân Y thực hiện, đã hoàn thành giai đoạn I và II và vừa bắt đầu giai đoạn III.
Tuy các nhà thử nghiệm cho biết đã định lượng được liều sử dụng an toàn, và tác dụng kích ứng miễn dịch tốt, nhưng kết quả này chưa được bình duyệt bởi một tạp chí khoa học có uy tín.
Như trên đã phân tích, trong hoàn cảnh đại dịch thì việc "vừa chạy vừa xếp hàng" đã xảy ra cho hầu hết các quốc gia, kể cả những hãng sản xuất vaccine uy tín nhất.
Theo ý kiến cá nhân tôi, Nanocovax tiến sang được giai đoạn III đã là một thành công lớn. Trong hoàn cảnh đại dịch đang quay trở lại Việt Nam, các tác giả hãy cấp tốc:
1) Viết bài công khai kết quả nghiên cứu giai đoạn I và II cho tạp chí quốc tế. Theo tôi biết thì hiện nay các tạp chí quốc tế đều có chính sách ưu tiên công bố cho các nghiên cứu trong lĩnh vực khẩn cấp này. Nếu các bạn tin rằng phương pháp nghiên cứu của mình là đúng, thì hãy đưa ra cho bên thứ ba đánh giá công khai.
2) Đăng ký mở rộng số lượng người tham gia thử nghiệm giai đoạn III để chính phủ có cơ sở tiến tới cấp phép sử dụng khẩn cấp. Tuy nhiên không nên yêu cầu chính phủ phải làm một việc bất đắc dĩ là chính thức chấp nhận sử dụng ngay bây giờ, dù là trong hoàn cảnh khẩn cấp, một vaccine mà số liệu của nó chưa được công bố bình duyệt.
*Những tài liệu tham khảo:
(1) Tham khảo: Australian National Centre for Immunization Research and Surveillance. "Phases of clinical trials".
(2) Tham khảo: Baraniuk C. "Covid-19: What do we know about Sputnik V and other Russian vaccines?". BMJ 2021;372:n743 (19/3/2021).
(3) Nguồn: Baraniuk C. "What do we know about China’s covid-19 vaccines?". BMJ 2021;373:n912 (9/4/2021).bắc